«Ситуация улучшилась колоссально». Как создают новое лекарство против рака
/ Перейти в фотобанк
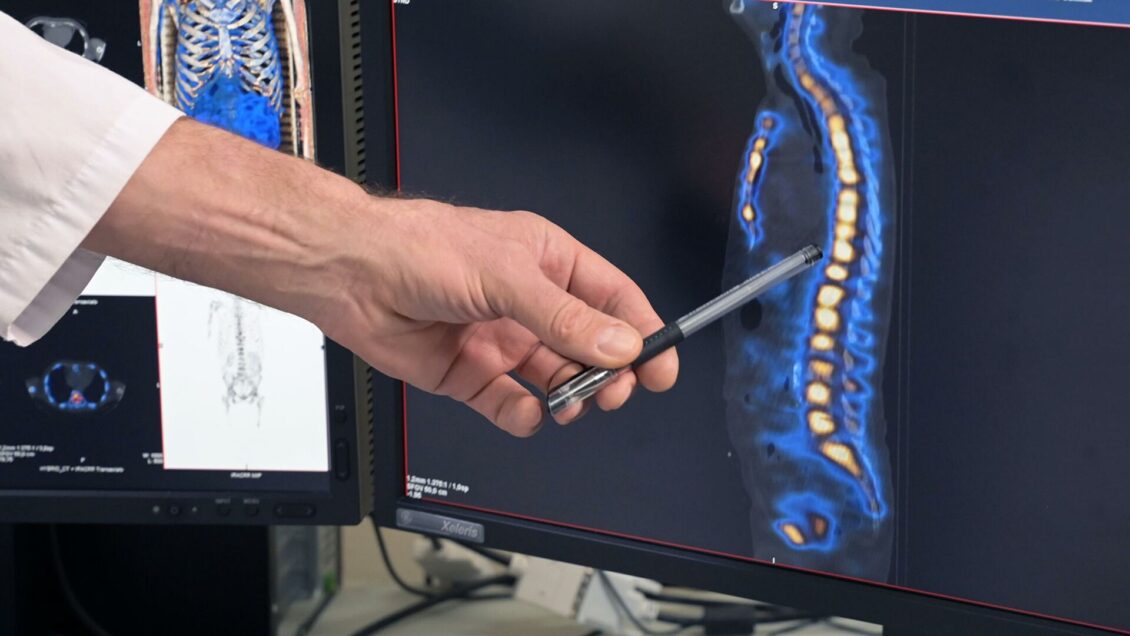
Перейти в фотобанкЧитать ria.ru в Сегодня в лечении рака достигли невероятных успехов, о которых нельзя было и мечтать еще в конце XX века. В авангарде — ядерная медицина, которую вот уже 60 лет успешно развивают в Обнинске в Медицинском радиологическом научном центре имени А. Ф. Цыба. В День борьбы с раком РИА Новости рассказывает о созданных там уникальных препаратах и технологиях, которые сохраняют жизнь тысячам пациентов.
Лечение заряженными ионами
Три года назад в Обнинске открылся Центр протонной терапии, где лечат самые тяжелые опухоли. Облучают пучком протонов из ускорителя. Только не научного, а компактного медицинского.Кольцевой синхротрон диаметром всего пять метров установили в отдельном здании. Сюда привозят пациентов, усаживают в специальное кресло, надевают маску и проводят сеанс.Протоны проникают в ткани на глубину семь-десять сантиметров, при этом пучок практически не рассеивается. Вся его энергия выплескивается в конечной точке пробега — пике Брегга. Частицы поражают клетки и ДНК. Самое сложное — правильно подобрать параметры, чтобы направить луч точно в опухоль, не затронув окружающие ткани. С протонами это легче, чем с электронами и фотонами. / Перейти в фотобанк

Перейти в фотобанкКомплекс «Прометеус» для протонной терапии рака. Синхротрон (циклотрон) диаметром 5 метров и весом около 20 тонн в отделении экспериментальной ядерной медицины МРНЦ имени А. Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава РоссииУченые сравнивают протонный пучок со скальпелем, который буквально выжигает злокачественное образование. Только в отличие от реального инструмента он не травмирует соседние ткани. А значит, его можно использовать для неоперабельных опухолей в голове и шее, рядом с критически важными органами.»Машина настолько элегантно сделана, что ею способны управлять буквально несколько человек — операторы, медицинские физики. У всех высокая квалификация, позволяющая качественно лечить», — отмечает инженер отдела радиационной биофизики МРНЦ имени А. Ф. Цыба Вячеслав Сабуров.Эту уникальную установку изобрел российский ученый, сотрудник Физико-технического центра ФИАН Владимир Балакин. Он начинал в Новосибирске под руководством советского физика-ядерщика Герша Будкера, затем переехал в подмосковный наукоград Протвино. Там в 1990-е и воплотил в жизнь свои идеи. В 2017-м его комплекс протонной терапии «Прометеус» получил статус медицинского изделия. А включение в список доступных по ВМП (высокотехнологичной медицинской помощи) помогло расширить круг пациентов. Несколько установок закупили иностранные научные и медицинские организации.

1 из 3Отделение протонной терапии МРНЦ им. А.Ф. Цыба, филиал ФГБУ НМИРЦ Минздрава России. Вячеслав Сабуров, инженер отдела радиационной биофизики. / Перейти в фотобанк

2 из 3
Медицинский физик за работой на комплексе протонно-лучевой терапии для лечения онкологических заболеваний. Слева — анатомический макет головы для расчета параметров облучения
Перейти в фотобанк / Перейти в фотобанк
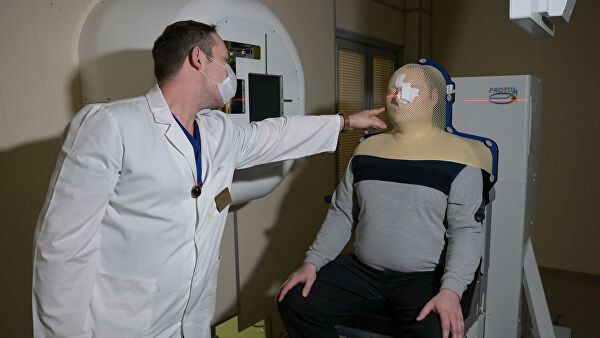
3 из 3
Пациент готов к облучению пучком протонов для лечения опухоли в носовом отделе головы
Перейти в фотобанк1 из 3Отделение протонной терапии МРНЦ им. А.Ф. Цыба, филиал ФГБУ НМИРЦ Минздрава России. Вячеслав Сабуров, инженер отдела радиационной биофизики.2 из 3
Медицинский физик за работой на комплексе протонно-лучевой терапии для лечения онкологических заболеваний. Слева — анатомический макет головы для расчета параметров облучения
Перейти в фотобанк3 из 3
Пациент готов к облучению пучком протонов для лечения опухоли в носовом отделе головы
Перейти в фотобанк»В США работают три таких ускорителя, в Австралии создали первый протонный центр на основе того кольца», — уточняет Сабуров.По его словам, «Прометеус» значительно дешевле зарубежных аналогов. А это главное для массового здравоохранения.»Очень важно было построить его в Обнинске, чтобы развивать эту технологию и сделать доступной для пациентов со всей страны», — добавляет физик.В России сейчас три центра протонной терапии, в том числе в Димитровграде и Санкт-Петербурге. А нужно не менее сотни. Только в Обнинске за год лечение получили шестьсот пациентов.Здесь развивают еще один прорывной метод — ионами углерода. Это довольно тяжелые частицы, требующие больше энергии для разгона. Ученые ИФВЭ в Протвино сделали отдельный канал вывода с крупных научных ускорителей. Испытания на культурах клеток и животных продолжаются не первый год. Результаты весьма обнадеживающие. Физики готовы спроектировать полноценный медицинский центр углеродной терапии.
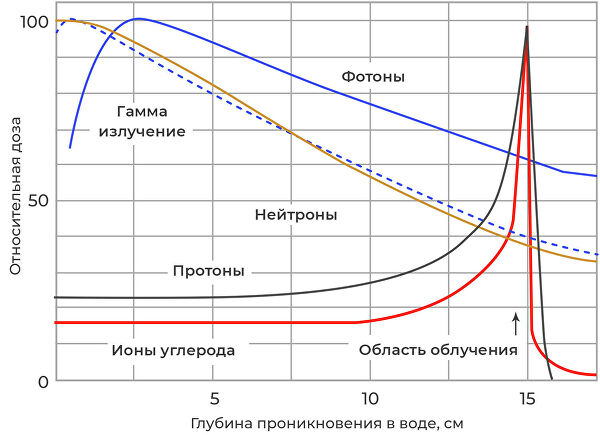
Пик Брэгга для разных видов излучения. Справа видно, что протоны и ионы углерода резко тормозят в конце своего пробега, сбрасывая всю энергию
Полезная радиация
«Более 80 лет назад, 31 марта 1941-го, в мире впервые применили радиоактивный йод для лечения пациентки с тиреотоксикозом. Это считается днем возникновения тераностики: терапия плюс диагностика. Йод стал самым популярным препаратом в радионуклидной терапии, мы его применяем с 1982-го», — рассказывает Валерий Крылов, заведующий отделением радиохирургического лечения открытыми нуклидами МРНЦ.Радиоактивный изотоп — это неустойчивый атом, который излучает энергию и со временем превращается в другой химический элемент. Так, йод-131 испускает мягкое гамма- и рентгеновское излучение, губительное для клеток. Этот изотоп, как и обычный йод, целенаправленно поглощают клетки щитовидной железы для генерирования гормонов, что и сделало возможным терапию. / Перейти в фотобанк

Перейти в фотобанкЗаведующий отделением, врач-радиолог Валерий Крылов в отделении радиохирургического лечения открытыми радионуклидами МРНЦ им. А. Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава РоссииРадионуклиды накапливаются в тканях, их хорошо видно при сканировании в гамма-камере и ПЭТ-томографе. Диагностику нередко сочетают с лечением, используя один и тот же препарат.Помимо йода, используют множество изотопов, например, самарий-153. Его, кстати, тоже получают в Обнинске. Однако прежде чем лечить этими радионуклидами, нужно получить их в виде препарата, то есть соединить с носителем, доставляющим лекарство в раковые клетки. Это суть таргетной терапии.
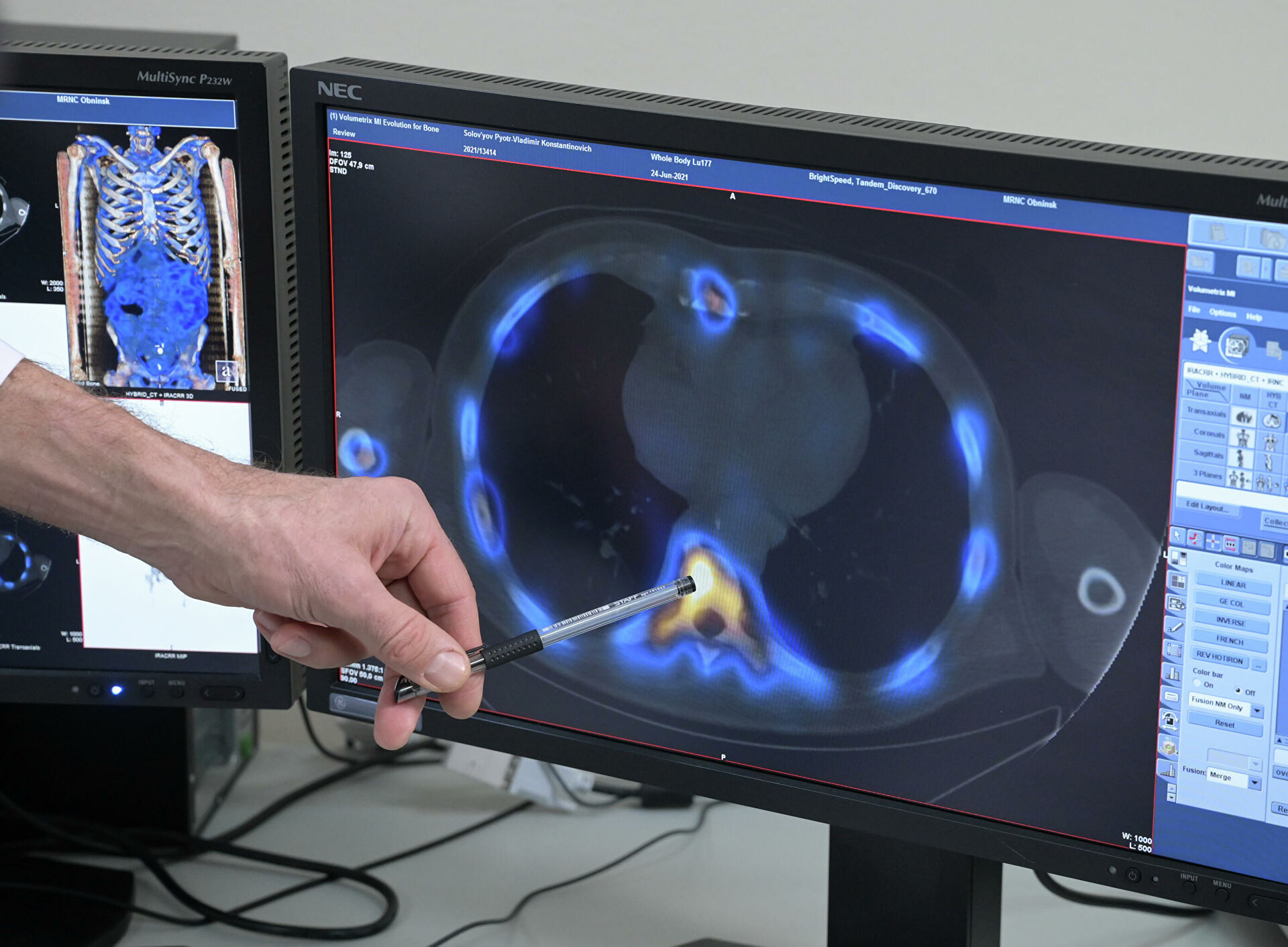
Визуализация метастаз в позвонке с помощью радионуклидов. МРНЦ имени А. Ф. ЦыбаИменно в МРНЦ впервые в мире создали и испытали таргетный препарат на основе рения-188. Сейчас экспериментируют с лютецием-177 для лечения рака предстательной железы.Дорогу этому методу проложило открытие особых молекул на поверхности клеток простаты — простатспецифических мембранных антигенов (ПСМА). Когда клетки перерождаются в раковые, концентрация ПСМА-рецепторов увеличивается. Остается только создать связующую молекулу (лиганд), которая узнает ПСМА-рецепторы и прикрепится к ним, и навесить на нее радиоактивный изотоп. Такой комплекс запускают в вену, лиганд по кровотоку находит опухоль, а радионуклид начинает ее разрушать. / Перейти в фотобанк
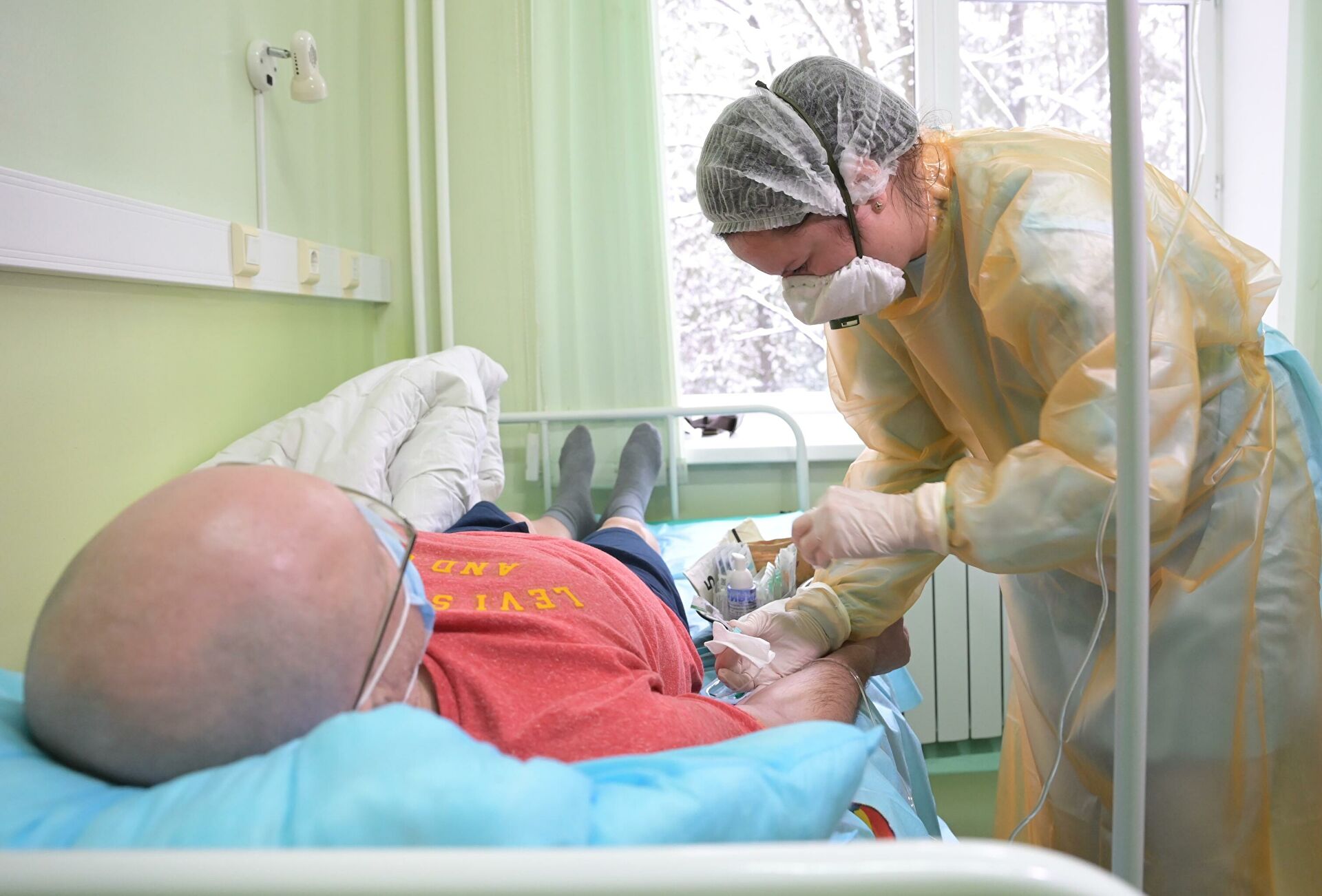
Перейти в фотобанкМедсестра вводит пациенту радиоактивный фармацевтический препарат (изотоп йода) «Это придумали, чтобы выявлять метастазы. Теперь к носителю цепляют боевой заряд, он с помощью альфа- и бета-излучения убивает раковые клетки», — поясняет Василий Петриев, заведующий лабораторией экспериментальной ядерной медицины.Все элементы таргетного препарата получают в России. Пептидный носитель поставляет компания «Фармсинтез», а лютеций-177 вырабатывают в Димитровграде.Чтобы сделать таргетный препарат, нужно много опытов, в том числе на животных. Им подсаживают злокачественные клетки предстательной железы человека, вводят в хвостовую вену лекарство и смотрят, что происходит.Лютеций-177 предназначен для самых запущенных опухолей, давших множественные метастазы. Экспериментальное лечение в клинике с 14 мая 2021-го получили уже 30 пациентов, впереди клинические испытания.»Два-три десятилетия назад выживаемость была в разы ниже, потому что еще не существовало таким емких схем терапии рака молочной и предстательной желез. Сейчас ситуация улучшилась колоссально, в том числе за счет таргетной терапии, обилия радиофармпрепаратов», — подчеркивает доктор Крылов. / Перейти в фотобанк

Перейти в фотобанкЗаведующий лабораторией экспериментальной ядерной медицины Василий Петриев в лаборатории, где проводят доклинические испытания. Мышам с человеческим раком простаты в хвостовую вену вводят препарат лютеция-177
Ядерный чемоданчик
Чтобы радионуклиды были в любой онкоклинике по стране и миру, их нужно безопасно перевозить. Для этого есть специальные герметичные контейнеры, в которых также готовят растворы, — генераторы, созданные в Физико-энергетическом институте имени А. И. Лейпунского.»Если он упадет даже с самолета, останется целым», — всерьез замечает научный руководитель НТК изотопов и радиофармпрепаратов ФЭИ Николай Нерозин. / Перейти в фотобанк

Перейти в фотобанкМакет мобильного генератора рения-188 «ГРЕН-1» производства АО «ГНЦ РФ — ФЭИ в Государственном научном центре Российской Федерации — Физико — Энергетическом институте Имени А. И. ЛейпунскогоВнутри — стеклянная колонка с веществом, сорбирующим материнский радионуклид. В данном случае это вольфрам-188 с периодом полураспада 69 дней. Его дочерний изотоп рений-188 используют в радиофармпрепаратах.»Генератор рения служит до полугода, рассчитан примерно на сто порций. Радиофармпрепарат из него получают в клинике и сразу применяют», — комментирует физик.В этом году ученые из ФЭИ зарегистрировали свое изобретение и теперь могут отправлять рений-188 в разные регионы, чтобы с ним экспериментировали. В Обнинске пробуют создавать микросферы с этим изотопом, а также в соединении с альбумином. В мире пока нет ни одного препарата с рением-188, прошедшего все этапы клинических испытаний, и у России есть шанс стать лидером в этом направлении. / Перейти в фотобанк

Перейти в фотобанкОфтальмоапликаторы с изотопом стронций-90, предназначенные для лечения злокачественных образований глазаВ ФЭИ производят также изотопы актиния-255, которые называют будущим ядерной терапии. Их получают еще только в Германии и США, в основном облучением радия-266 на ускорителе с использованием фотоядерной реакции.Этот изотоп живет несколько дней, поэтому его постоянно надо нарабатывать. В год в мире удается собрать всего 1,5 кюри, а требуется сто. Чтобы добыть больше, нужно развивать новые подходы, например, в НИИАР в Димитровграде это делают в реакторе. «Уникальный изотоп с периодом полураспада десять дней, у него очень маленький пробег, но большая энергия излучения, и если доставить его прямо в клетки опухоли, то он убьет лишь их», — заключает Николай Нерозин.В ближайшее время ученые намерены найти транспортную молекулу для актиния-255.

Микросферы с изотопом иттрия-90 для лечения поздних стадий рака печени и метастаз в печень

